TITRASI ASAM - BASA ASIDI ALKALIMETRI lanjutan ASAM-BASA POLIFUNGSIONAL CONTOH. Fenolftalen adalah pewarna yg berperan sebagai indicator ph.

Lihat Contoh Soal Materi Titrasi Asam Basa Terbaik Belajar Membaca Kimia
INDIKATOR ASAM-BASA Untuk mengetahui suatu larutan bersifat asam atau basa salah satunya dapat menggunakan indikator asam basa.

Na2c2o3 adalah asam atau basa. Ion lain yang terbentuk adalah ion klorida Cl Asam klorida oleh karenanya dapat digunakan untuk membuat garam klorida seperti natrium kloridaAsam klorida adalah asam kuat karena ia berdisosiasi penuh dalam air. Contoh basa polifungsional Na2CO3 Reaksi ionisasi dalam dua tahapan. Jika kamu punya dua larutan tersebut.
Jika 1 mol NaOH 1 mol H2A Reaksi yang terjadi. Na2S adalah garam dari asam lemah H2S dan basa kuat NaOH. Garam dari asam kuat dan basa lemah garam ini bersifat asam pH.
Adalah larutan yang didapat dari hasil reaksi asam dan basa. CH3COOH HF HNO2 H2S HCN Basa Basa Kuat. Natrium Tiosulfat Na2S2O3 adalah salah satu jenis dari garam terhidrat.
Sebagai contoh adalah garam ammonium klorida NH 4 C. Asam-asam klorida dan sulfat merupakan larutan asam yang paling luas digunakan sebagai larutan standar meskipun tidak satupun mencukupi semua persyaratan di atasGaram klorida dari ion-ion perak timbale dan merkuri I adalah larut seperti halnya sulfat dari logam-logam alkali tanah dan timbaleNamun hal ini tidak menyebabkan kesukaran pada. Ion tiosulfat dapat diperoleh secara cepat dengan cara mendidihkan belerang dengan non sulfit atau dengan cara mendekomposisi ion ditionit.
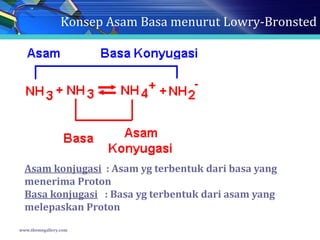
ASAM EDETAT EDTA H 4 Y Asam Edetat EDTA. Larutan asam basa memiliki kadar kekuatannya masing-masing dan ada yang termasuk dalam Asam Kuat Asam Lemah Basa Kuat dan Basa Lemah. Adalah ligan heksadentat 4 di gugus karboksilat 2 di gugus amino Sophie Damayanti SF ITB.
Garam dari asam kuat dan basa kuat garam ini bersifat netral pH 7. Macam-macam indikator asam basa yaitu Lakmus Metil jingga Metil merah Bromtimol biru dan PP. Garam merupakan suatu senyawa yang terbentuk jika hidrogen.
Ion karbonat CO 3 2 adalah basa dalam air membentuk ion hidrogen karbonat yang pada gilirannya membentuk asam karbonat. Larutan asam mempunyai pH 7. Pengertian Larutan Garam Sifat Ciri Jenis dan Contohnya.
Oleh karena itu maka dibuat makalah ini sebagai tugas dalam mata kuliah Kimia Anorganik II agar mahasiswa lebih mampu memahami segala aspek yang berkaitan dengan teori asam basa. NaHCO3 M HCl. Indikator asam-basa ada yang berupa indikator alami dan indikator buatan.
Reaksi ionisasi dalam tiga tahapan. CH 2 COOH CH 2 COOH HOOCCH 2. Indikator asam-basa adalah zat warnanya berubah bergantung pada pH larutan indicator asam-basa digunakan untuk menentukan sifat keasaman atau kebasaan suatu larutan.
Vmj-VppMr NaHCO3 x 100. Berikut adalah daftarnya Asam Asam Kuat. Baca Juga Artikel Yang Mungkin Berhubungan.
Asam juga dapat diartikan zat yang dapat memberi proton ion H kepada zat lain yang disebut basa atau dapat menerima pasangan elektron bebas dari suatu basa. Garam dapat terbentuk dari 4 reaksi kimia. Dalam kimia asam adalah senyawa kimia yang bila dilarutkan dalam air akan menghasilkan larutan dengan pH lebih kecil dari 7.
Telah habis bereaksi maka kelebihan asam dengan indicator mj akan merubah warna larutan dari kuning ke orange atau peach reaksinya sebagai berikut. Menghitung pH dari larutan garam yang masih mengandung asam NaHA HA- Contoh. Asam monoprotik memiliki satu tetapan disosiasi asam K a yang mengindikasikan tingkat disosiasi zat tersebut dalam airUntuk asam kuat seperti HCl.
Larutan asam memiliki pH rendah sementara larutan basa memiliki pH tinggi. Reaksi secara keseluruhan adalah sebagai berikut. Lewis mengemukakan teori asam basa yang lebih luas dibanding kedua teori sebelumnya dengan menekankan pada pasangan elektron yang berkaitan dengan struktur dan ikatanMenurut definisi asam basa Lewis.
Tujuan Adapun tujuan dari pembuatan makalah ini adalah sebagai berikut. Dalam ilmu kimia pH piːˈeɪtʃ adalah skala yang digunakan untuk menentukan sebarap asam atau basa suatu larutan berbasis air. Sebagai salah satu contoh dari titrasi jenis khusus ini adalah larutan Na2CO3 yang dititrasi dengan larutan HCl.
Contoh Soal Asam Basa Pilihan Ganda dan Jawaban beserta Pembahasan Pada tahun 1923 G. Na2CO3 M HClVppMr Na2CO3 x 100. Asam etilen diamin tetra asetatNCH 2 CH 2 N.
April 2 2015 roiyan98 Puisi 7 Komentar. Berikut daftar Asam Kuat Basa Kuat Asam Lemah dan Basa Lemah-Pada bab asam dan basa SMA IPA Kelas 11 Asam dan basa dibedakan menjadi beberapa golonganAdapun golongan tersebut yakni asam basa kuat serta Asam Basa lemah. Basa lemah diprotik atau asam lemah diprotik jika masing-masing kita titrasi dengan asam kuat atau basa kuat maka kita akan memiliki bentuk kurva yang unik.
Amonium klorida NH 4 Cl terdiri dari kation NH 4 dan anion Cl. Daftar Asam dan Basa Kuat dan Lemah. Suatu larutan berair dari garam semacam itu jelas bersifat basa karena adanya ion OH- tambahan yang dihasilkan oleh hidrolisis anion.
Larutan mana sajakah yang termasuk dalam kedalamnya. Indikator adalah larutan yang digunakan untuk mengindikasikan secara visual dengan adanya perubahan warna. Pengertian Larutan Garam.
Pada temperatur ruangan air murni disebut memiliki pH. Garam dari basa kuat dan asam. Ion NH 4 berasal dari basa lemah yaitu NH 3.
Garam terhidrat adalah garam yang terbentuk dari senyawa-senyawa kimia yang dapat mengikat molekul-molekul air pada suhu kamar. Pratikum asam basa penentuan kadar Na2CO3 dan NaHCO3 dalam sampel. PH asam lebih rendah maupun pH basa lebih tinggi relatif terhadap pH netral.
Beberapa contoh garam yang dibentuk dari asam kuat dan basa lemah diantaranya adalah Al 2 SO 4 3 AgNO 3 CuSO 4 NH 4 Cl AlCl 3. Asam adalah akseptor pasangan elektron. Contohnya adalah NaCl KCl K 2 SO 4 CaNO 3 2.
HCl H2SO4 HNO3 HClO4 H3PO4 Asam Lemah. Jadi Na2S juga merupakan. Oleh bitar Diposting pada 5 Januari 2022.
Indikator asam- basa adalah zat yang mengalami perubahan warna dalam larutan dengan sifat yang berbeda. Reaksi kimia adalah sebagai berikut. Dasar Pengelompokan ini tentu ada jika kita tinjau kembali memang keduanya sangat berbeda.
Hidroksida atau oksida basa pd pH larutan yg sudah didapar untuk mencegah pengendapan Perlu ditambahkan. Untuk memenuhi nilai tugas mata pelajaran Kimia 2. Prinsip yang sama dapat diterapkan untuk deprotonasi penerimaan proton basa konjugat dari asam poliprotik.
Hal ini dijelaskan dengan perhitungan pH larutan ion karbonat.